Nutrition
Autofaagia mehhanismid: samm edasi paastumises
Vahelduv paastumine oli 2020. aasta populaarseim dieet. Ei ole oluline kas paastuti 16: 8, 5: 2, oluline on see, et sellest võttis osa 17 miljonit inimest USA-s. Nagu kõikide trendikate dieetide puhul, instagram mattus inimeste ja kuulsuste edulugude alla.
Kuid kas sa oled kunagi mõelnud, mis juhtub sinu kehaga, kui sa vahelduvat paastumist teed?
Mida ütleb teadus autofaagia ja paastumise kohta?
Täna räägin sellest täpsemalt, annan teadusliku ülevaate autofaagia ja vahelduva paastumise kohta, et sul oleks 100% tõene ülevaade sellest, mis sinu kehas tegelikult toimub.
Table of Contents
Mis on autofaagia?
Autofaagia ehk Autophagy pärineb sõnadest “auto” ja “phagy“. ‘Auto’ tähendab iseennast, ‘phagy’ tähendab söömist. Autofaagia tähendab sõna otseses mõttes „iseõgimist, kuid see on hea tähendusega! See on keha loomulik viis vabaneda surnud, kahjustatud ja vanadest rakkudest. Just nii saab keha toota ja uuendada terveid rakke.
Miks me alati sööme midagi
Umbes 2 miljonit aasta tagasi, kui inimesed arenesid ahvidest, oli aeg, mil toitu oli külluses. Oli ka toidunappuse aegu. Tänapäeval on suuremal osal maailma riikidest toit alati saadaval. Mis tähendab, et tavaelus ei ole meil söömise ja näljahäda vaheldumist nagu varem. Selle asemel oleme alati söömise režiimis.
Asi on selles, et meie areng toimus söömise ja näljahäda kannatamise vahel. See omakorda tähendab seda, et meie keha töötab ka kõige paremini siis, kui ta puutub kokku mõlema seisundiga – söömise ja näljaga.
- Kui meil on piisavalt toitu, siis saavad meie keharakud kasvada ja paljuneda, kui meil napib toitu, käivitab meie organism metaboolse seisundi (1), mis keskendub rakkude vastuse tugevdamise asemel hoopis stressile.
- Lagundatakse vanad ja defektsed rakukomponendid, uuendades ja parandades allesjäänud ning suurendatakse näiteks antioksüdantide tootmist.
- Lagundatud rakke saab seejärel kasutada uute rakukomponentide või energia tootmiseks.
Selleks, et me oleksime terved, vajame tasakaalu selle kahe seisundi vahel.
Vahelduva paastumise eelised ja puudused
Eelis: Kahjustunud rakud võivad kogunevad kehasse ja takistada teiste rakkude tööd. Kuna me koosneme rakkudest, tähendab see seda, et kannatab kogu keha.
Puudus: Nälgimine võib põhjustada probleeme, sest me kulutame liiga palju aega
oma rakkude lagundamisele energia tootmiseks.
Just seepärast vajame tasakaalu selle kahe seisundi vahel. Vahelduv paast võimaldab meil seda teha, sest siis esineb meil nii söömise kui ka näljaperioode.
mTOR vs. autofaagia.
Söömine ja nälgimise tasakaal avaldub kahe vastandliku protsessi vahel, mis toimuvad meie kehas korraga – mTOR ja Autofaagia.
mTOR – ensüüm, Lihavõttesaar ja kulturistide unistus!
mTOR on kasvuprotsess ning see tähendab rapamütsiini mehaanilist sihtmärki.
MTOR sai oma nimetuse mullabakterite järgi, mis avastati esmakordselt 1960. aastal Lihavõttesaare ekspeditsioonil. Lihavõttesaar on Vaikse ookeani saar umbes 2000 miili kaugusel Tšiili rannikust, mis on kuulus maailmapärandi nimistusse kuuluva üle 1000 iidse kuju tõttu. Lihavõttesaart tunnevad saareelanikud ka Rapa Nuina nime all, seetõttu nimetati bakterit Rapa Nuide saare järgi rapamütsiiniks.
mTOR ei ole tegelikult mullabakter – see on tegelikult meie kehas toodetud ensüüm. Kuid mullabakterid stimuleerivad rapamütsiini mTOR-i aktiivsust, nii et ensüüme hakati nimetama rapamütsiini mehaaniliseks sihtmärgiks. Kui seda ensüümi stimuleeritakse, hakkavad rakud kiiremini kasvama, tootma valke ja paljunema. mTOR on kulturistidele ja teistele jõusportlastele hästi tuntud ning üritataksevõimalikult palju stimuleerida.
Autofaagia- teadus ja paastumine
MTOR-i vastupidist protsessi nimetatakse autofaagiaks – protsess, kui rakud hakkavad lagundama vanu ja kahjustatud osi. Need kaks protsessi on vastastikused: mTOR-i stimuleerimisel on autofaagia madal ja autofaagia stimuleerimisel on mTOR madal.
Kuidas töötab autofaagia?
Fagofoorideks nimetatakse raku eristruktuure, mis moodustusid autofaafia käigus.
• Fagofoorid on membraanid, mis kasvavad aeglaselt tekitades membraaniga kaetud pallikuju.
• Membraan on valmistatud lipiidide kahekihilisest materjalist.
• Lipiidid on rasvapõhised molekulid ning kahekihilised lipiidid ümbritsevad kõiki meie rakkudes olevaid organelle ja ka kõiki meie rakke – kõiki 20 miljardit!
• Rakkude organellid täidavad meie rakkudes erinevaid funktsioone ja nad on justkui organid meie kehas.

Fagofoori moodustumine
Enne kui pall või fagofoor on valminud, liigub see rakkudes ringi. See kogub valgud ja muud organellid, millel on erimarker, mis omakorda saadab signaali fagofoorile, et see on valitud lagundamiseks. Seda erimarkerit nimetatakse ubikvitiiniks. Seejärel liigub fagofoor ümber raku, kogudes kõik ubikvitineeritud valgud ja organellid.
Fagofoori moodustamine lõpeb
Seejärel tekivad membraanid valkude ja organellide ümber. Kui see juhtub, siis muutub struktuuri nimi fagofoorist autofagosoomiks. Seejärel liigub see autofagosoom lüsosoomi suunas ja sulandub sellega. Lüsosoom on organell, mida võib pidada raku maoks, kuigi see ei vasta päris tõele, sest rakk sisaldab palju lüsosoome!
Kuid nagu ka meie maos, on lüsosoomide sisu happeline ja sisaldab seedetrakti ensüüme, mis lagundavad valke ja organelle. Kui need on jaotatud üksikuteks aminohapeteks, saab neid uuesti kasutada uute valkude, organellide ja isegi uute rakkude ehitamiseks. Neid võib kasutada ka maksas energia saamiseks, mida tuntakse kui glükoneogeneesi protsessi. Aminohapped, mida kasutatakse uute rakkude ja valkude ehituse jaoks, teevad seda mTOR ensüümi poolt stimuleerituna. Tsükkel lõpeb siis, kui kehas toimub kaks protsessi korraga – autofaagia ja mTOR.
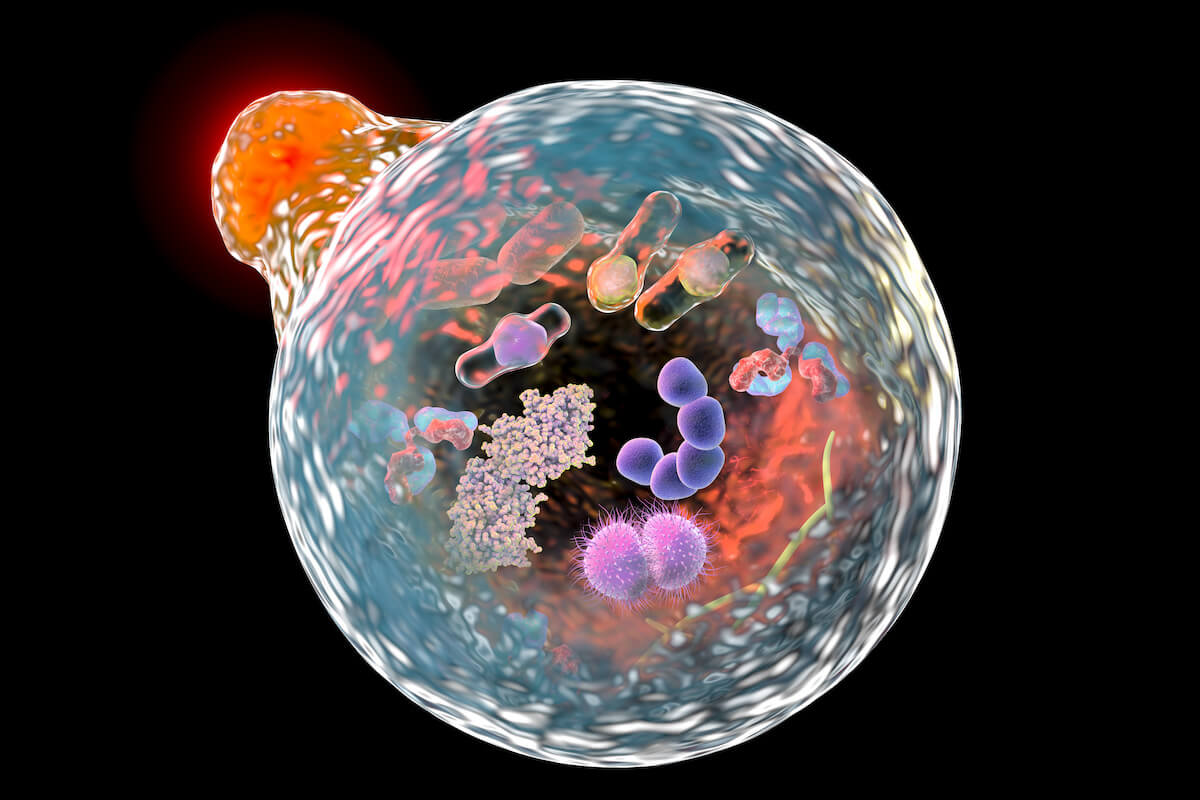
Suurem autofagosoom sulandub kokku oranži lüsosoomiga
On olemas teatud tüüpi autofaagia, mis tegeleb mitokondritega. See toimub mitokondrite selektiivse lagundamise protsessi kaudu, mida nimetatakse mitofaagiaks. Mitokondrid ning organellid on meie rakkude mootorid, mis toodavad energiat. Neid on igas rakus üle 2000.
Kuna me kasutame energia tootmiseks hapnikku ning just hapnik tekitab kehas oksüdatiivset stressi, meie mitokondrid on mõjutatud vabade radikaalide poolt. See omakorda tähendab seda, et nad on väga vastuvõtlikud kahjustustele. Kahjustatud mitokondrite lagundamine ja parandamine on mitofaagias kriitiline protsess.
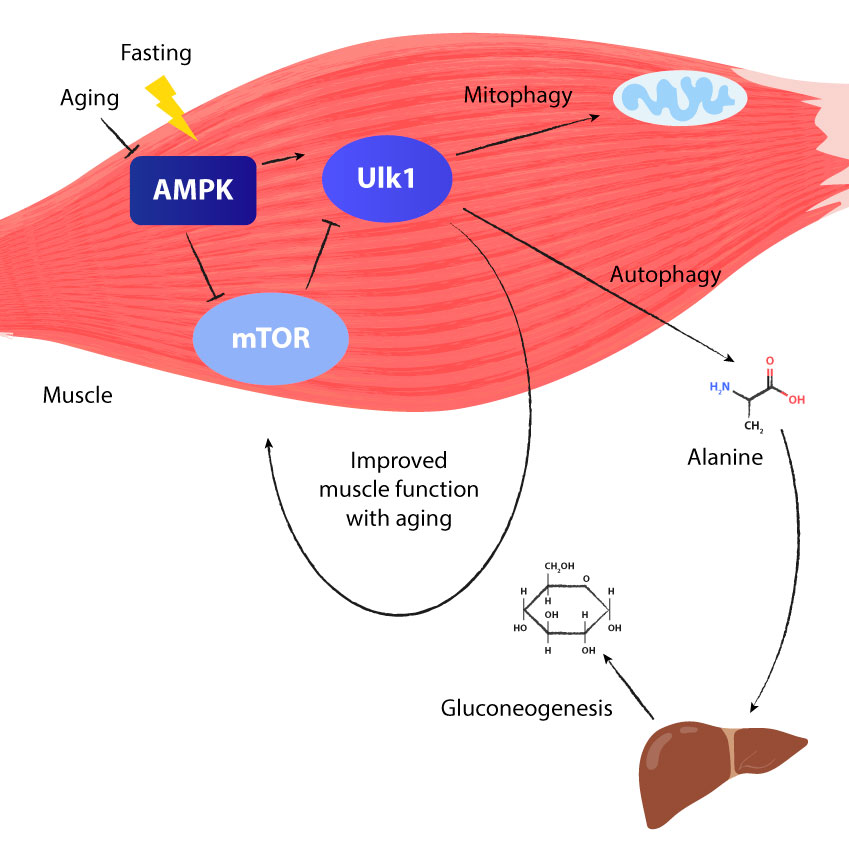
Kuidas paastumine stimuleerib autofaafiat ja mitofaagiat
Kui me paastume, väheneb toidu kaudu kehasse jõudev energia. See toob kaasa energia tasakaalustamatuse, sest energiat kulutatakse rohkem kui toodetakse. Spetsiaalne ensüüm jälgib seda energiabilanssi pidevalt: seda ensüümi nimetatakse AMPK-ks (adenosiinmonofosfaadiga aktiveeritud valgukinaas).
Seda nimetatakse AMP ja ATP suhteks.
ATP vabastab fosfaatmolekuli energia ja jaguneb ADP-ks. Kui energiat on vähe, ühendatakse 2 ADP-d ATP-ks, mis jätab järelejäänud AMP. (ATP on adenosiini molekul, millele on kinnitatud 3 fosfaati, ADP on adenosiini molekul, millele on kinnitatud 2 fosfaati ja AMP on adenosiini molekul, millele on kinnitatud 1 fosfaat).
ATP = Adenosiintrifosfaat (3 fosfaat)
ADP = Adenosiindifosfaat (2 fosfaat )
AMP = adenosiinmonofosfaat (1 fosfaat)
Kui kokku tuleb 2 ADP-d (2 fosfaati pluss 2 fosfaati), tekitab see ATP-d (3 fosfaati) koos AMP-ga (üks fosfaat jääb alles).
Kui AMP suhe ATP suhtes suureneb, annab see märku, et energiat on vähem ja seega stimuleeritakse AMPK-d. AMPK stimuleerib see teist valku nimega ULK1, mis viib fagofooriks muutuvate membraanide tootmiseni.

NAD + ja SIRTUIN
Paast tõstab ka NAD+ taset, mis on NADH oksüdeeritud vormi tase, mis on aktiivne B3-vitamiini vorm (oluline energiatootmiseks).
SIRTUIN-d on valkude perekond, mis stimuleerib otseselt autofaagiat
Mitokondrites energia tootmise tagajärjel saab rohkem NADH-st NAD +. See tõstab NAD + ja NADH stimuleerib SIRTUIN tootmist.
SIRTUIN on valkude perekond, mis stimuleerib otseselt autofaagiat. Nende tootmine on seotud ka eluea pikenemise ja DNA taastamise suurenemisega (2).
Nii AMPK kui ka SIRTUIN aktiveerivad ka teisi geene, millel on teadaolevalt palju kasu tervisele, sealhulgas FoxO perekond, TFEB, PGC-1a ja P53
- FoxO perekonna aktiveerimine on seotud suurenenud stressi vastupanuga, pikema eluea ja madalama kasvaja (s.t vähkide) esinemissagedusega. Selle põhjuseks on düsfunktsionaalsed rakud, mis pannakse rakulist enesetappu tegema (apoptoos), selle asemel, et jätkata kasvu ja potentsiaalselt kasvajaks muutumist (3).
- TFEB on uute lüsosoomide tootmise peamine stimulaator, seega on ta otseselt seotud autofaagiaga.
- P53 on tuntud kui “genoomi valvur”, kuna see takistab DNA mutatsioone (4) ja pärsib kasvajate teket (5).
PGC-1a on peamine geen, mis on seotud uute mitokondrite tootmise stimuleerimisega. Mida rohkem on meil mitokondreid, seda vähem on meie olemasolevatel mitokondritel stressi vajaliku energia tootmiseks. Muutes meie energiatootmise tõhusamaks ja mida tõhusam see on, seda vähem on meil vabu radikaale.
Ketoosi roll autofaagias
Vahelduv paastumine viib rasvkoe lagunemiseni, suurendades maksa saabuvate vabade rasvhapete taset. Ta suurendab toodetud ketoonide hulka (1).
Ketoonid on rasvapõhised molekulid, mis toodavad energiat.
Ketoonid on rasvapõhised molekulid, mis toodavad energiat. Põletades ketoone energia saamiseks toodab vähem vabu radikaale ja vähendab põletikku. Ketoonid stimuleerivad ka BDNF (ajupõhine neurotroofne faktor) tootmist. BDNF on aju kasvuhormoon ja stimuleerib uute ajurakkude (neuronite) kasvu. See soodustab ka uusi sünapse, mis on ühendatud neuronitega (1). Mida rohkem on meil seoseid või sünapsi, seda rohkem saame õppida ja mõista.
Miks on vahelduv paastumine nii populaarne 2021.aastal
Niisiis, kuidas on vahelduv paastumine tegelikult tervisele kasulik?
Kaalulangetamine
Paljud inimesed otsustavad proovida paastumis kaalulangetamise jaoks. Uuringud on näidanud, et 3-6-kuulise perioodi jooksul kaotavad inimesed paastumise ajal 2,5–9,9% oma kehakaalust (7, 8). Samuti tuleneb kaalulangus rasvast mitte lihasmassist.
Paast aitab reguleerida glükoosi ja insuliini taset
Uuringud on näidanud, et vahelduv paastumine vähendab ka glükoosi ja insuliini taset diabeetikutel (10), rasvunud inimestel (7) ja tavalise kehakaaluga inimestel (11). Läbiviidud uuring, mis keskendus noorte ülekaaluliste naistele näitas, et üld- ja LDL-kolesterooli, triglütseriidide ja vererõhu langus on vähenenud. Leiti ka põletikulise markeri C-reaktiivse valgu ja hormooni leptiini vähenemise, mis tavaliselt tõuseb rasvumise korral.
Paast aitab testosterooni reguleerida
Samuti leiti, et paast kasvatab SHBG (suguhormoone siduv globuliin) sisaldust, mis aitab vähendada testosterooni taset. Kuid kui testosteroon tõuseb naistel liiga kõrgeks, võib sellel olla soovimatud kõrvaltoimed (12).
Vahelduv paastumine võib avaldada isegi vananemisvastast toimet
Suur osa uuringuid, mis keskenduvad seoses leidmisele paastumise ja vananemise vahel viidi läbi loomade peal. Põhjus on lihtne – selliseid uuringuid on inimeste peal väga keeruline läbi viia, kuna me ei saa inimesi kogu elu jälgida ja tagada, et nad hoiaksid kinni paastumise protokollist.
AMPK ja SIRTUIN stimulatsioon vahelduva paastumise puhul on tugevalt seotud loomade eluea pikenemisega.
Uuringud on näidanud, et vahelduv paastumine pikendab hiirte ja ahvide eluiga ning muudab vananemisega seotud haiguste tekkimise vähem tõenäoliseks (13). Ühes uuringus, milles uuriti hiiri selgus, et paastunud hiired kaotasid vananedes vähem lihasmassi (9).
Järeldus: kas autofaagia stimuleerimine vahelduva paastumise abiga on seda tegelikult väärt?
Vahelduval paastumisel võib olla tervisele väga positiivne mõju:
- See võib stimuleerida autofaagiat.
- See on seotud pikema elueaga.
- See võib stimuleerida uute mitokondrite tootmist.
- See võib vähendada põletikku ja parandada südame-veresoonkonna tervist.
Ehkki me juba teame suurepärastest eelistest, ei ole ma kordagi maininud ühtki võimalikku paastumisest tulenevat probleemi. Peame olema kindlad selles, et me paastume mitte ei nälgi!
Kui paastutakse õigesti, siis ei tohiks see tekitada selliseid halbu kõrvaltoimeid nagu pearinglus, nõrkus, ärrituvus või midagi muud, mis on väga ebameeldiv.
Natuke näljasena tundmine on OK, kuid kui sa tunned end halvasti või arvad, et sa ei jõua oma söömisajani oodata, tähendab see, et oled nälgimas.
Nälgimine juhtub siis, kui me ei tooda oma aju tööks piisavalt ketoone. Kui söömise ajal ei saa meie aju piisavalt energiat, siis tajub aju seda kui toidupuudust.
Seejärel teeb ta kõik endast oleneva, et me lõpetaksime kõik oma tegemised ja säästaksime energiat.
Olen kirjutanud üksikasjaliku juhendi selle kohta, kuidas vältida nälgimise signaale nii et palun loe seda enne, kui otsustad paastuda. Õige teabe ja vahelduva paastu mõistmise korral peaksid enamus inimesi proovima ja tundma kõiki positiivseid eeliseid tervisele!
Allikad
References
(1) Stephen D. Anton, Keelin Moehl, William T. Donahoo, Krisztina Marosi, Stephanie Lee, Arch G. Mainous, III, Christiaan Leeuwenburgh, and Mark P. Mattson, Flipping the Metabolic Switch: Understanding and Applying Health Benefits of Fasting, Obesity (Silver Spring). 2018 Feb; 26(2): 254–268.
(2) Uribarri J, Woodruff S, Goodman S, Cai W, Chen X, Pyzik R, et al. Advanced glycation end products in foods and a practical guide to their reduction in the diet. J Am Diet Assoc. 2010;110: 911–916
(3) Eric L Greer & Anne Brunet, FOXO transcription factors at the interface between longevity and tumor suppression, Oncogene volume 24, pages7410–7425(2005)
(4) Read AP, Strachan T (1999). “Chapter 18: Cancer Genetics”. Human molecular genetics 2. New York: Wiley.
(5) Surget S, Khoury MP, Bourdon JC (December 2013). “Uncovering the role of p53 splice variants in human malignancy: a clinical perspective”. OncoTargets and Therapy. 7: 57–68.
(6) Sanchis-Gomar F, García-Giménez JL, Gómez-Cabrera MC, Pallardó FV (2014). “Mitochondrial biogenesis in health and disease. Molecular and therapeutic approaches”. Curr. Pharm. Des. 20 (35): 5619–5633.
(7) Heilbronn LK, Smith SR, Martin CK, Anton SD, Ravussin E. Alternate-day fasting in nonobese subjects: effects on body weight, body composition, and energy metabolism. Am J Clin Nutr [Internet] 2005;81:69–73.
(8) Byrne NMM, Sainsbury A, King NAA, Hills APP, Wood REE. Intermittent energy restriction improves weight loss efficiency in obese men: the MATADOR study. Int J Obes [Internet] 2017:1–10.
(9) Van Norren K, Rusli F, Van Dijk M, Lute C, Nagel J, Dijk FJ, Dwarkasing J, Boekschoten MV, Luiking Y, Witkamp RF, Müller M, Steegenga WT, Behavioural changes are a major contributing factor in the reduction of sarcopenia in caloric-restricted ageing mice.
J Cachexia Sarcopenia Muscle. 2015 Sep; 6(3):253-68.
(10) Deng X, Cheng J, Zhang Y, Li N, Chen L. Effects of caloric restriction on SIRT1 expression and apoptosis of islet beta cells in type 2 diabetic rats. Acta Diabetol. 2010;47(suppl 1):177–85.
(11) M’guil M, Ragala MA, El Guessabi L, Fellat S, Chraibi A, Chabraoui L, et al. Is Ramadan fasting safe in type 2 diabetic patients in view of the lack of significant effect of fasting on clinical and biochemical parameters, blood pressure, and glycemic control ? Clin Exp Hypertens. 2008;30:339–57.
(12) Harvie MN, Pegington M, Mattson MP, Frystyk J, Dillon B, Evans G, et al. The effects of intermittent or continuous energy restriction on weight loss and metabolic disease risk markers: A randomized trial in young overweight women. Int J Obes. 2011;35:714–27.
(13) Beneficial effects of intermittent fasting and caloric restriction on the cardiovascular and cerebrovascular systems. Mattson MP, Wan RJ, Nutr Biochem. 2005 Mar; 16(3):129-37.

